Algas
Producción Acuícola
Las Algas de Importancia en Chile
La acuicultura de macroalgas es una actividad milenaria que ha sido desarrollada principalmente en países asiáticos, donde forman parte importante de la dieta de las personas. Por el contrario, en occidente las macroalgas se comercializan principalmente como materia prima para ser usada en la industria de los ficocoloides, los cuales son polímeros naturales que confieren volumen, textura y viscosidad a una variada gama de productos en la industria cosmética, médica y alimenticia. También se ha propuesto su uso como “especies bioextractivas” en ambientes afectados por el aumento de materia orgánica y nutrientes en la costa asociados a la acuicultura intensiva (ej. Salmonicultura).
Extraccción de Algas en Chile
Esta se realiza a lo largo de toda la costa. Sin embargo, los mayores registros se alcanzan en la zona norte desde las regiones de Tarapacá a Coquimbo, principalmente sobre especies de algas pardas (géneros Durvillaea, Macrocystis y Lessonia). En la zona centro en la región de Ñuble en algas pardas y rojas (luga negra o crespa) y en la zona sur, en la región de Los Lagos, principalmente sobre el recurso pelillo (Gracilaria chilensis).
Chile es el principal productor de macroalgas de occidente. Sin embargo, el grueso de su producción proviene de la explotación de praderas naturales y en menor escala desde actividades de cultivo. Durante el año 2018 se extrajeron en nuestro país alrededor de 222 mil toneladas de macroalgas, de este total, destacan especies como huiro negro (Lessonia berteroana-Lessonia spicata), pelillo (Gracilaria chilensis) y huiro palo (Lessonia trabeculata) con un 28.6%, 16,8% y 16.3%, respectivamente. Si bien, la acuicultura en Chile continúa dominada por la salmonicultura, mitilicultura y pectinicultura, el cultivo de macroalgas representa una alternativa de desarrollo que promete diversificar el sector pesquero artesanal, mejorar la economía costera local y disminuir la sobreexplotación de las praderas naturales.
Hasta ahora, el cultivo de macroalgas se encuentra representado casi exclusivamente por pelillo (Gracilaria chilensis) que sólo alcanza el 1,5% de la producción total de la acuicultura nacional. Otras iniciativas se refieren al repoblamiento, que corresponden a medidas de manejo de praderas naturales, que es otra herramienta que favorece la producción de algas de importancia económica en nuestro pais.
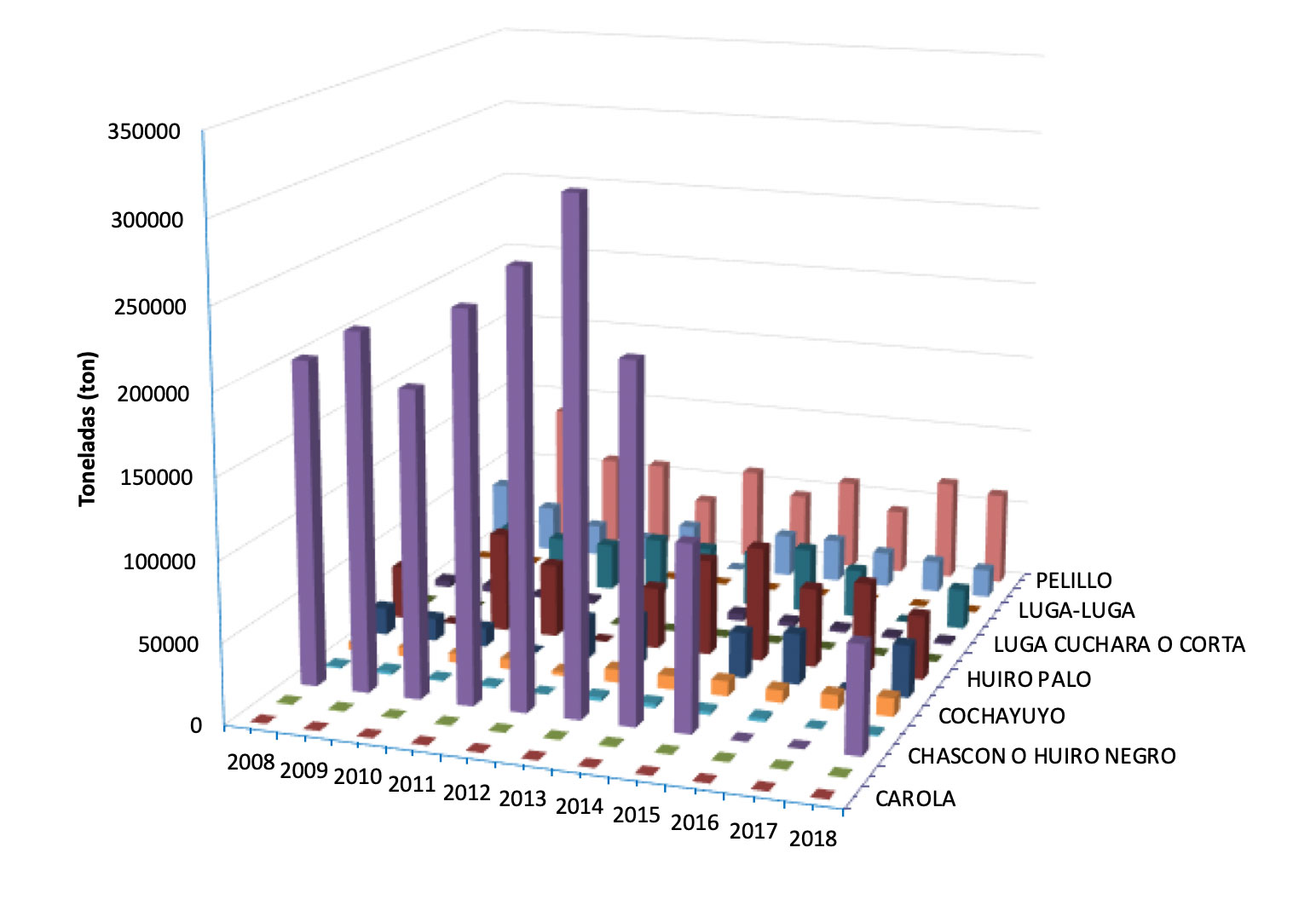
Desembarque total de algas de importancia comercial en Chile desde el año 2008 al 2018. FUENTE: Anuario estadístico de Pesca, SERNAPESCA.
Agarófitas
Se refiere a las algas rojas que forman praderas en la zona intermareal (e.g., pelillo). Son reconocidas como productoras de agar, una sustancia gelatinosa o polisacárido compuesto por un azúcar simple llamado galactosa. Las principales especies son: pelillo; chasca delgada; chasca gruesa.
“Pelillo” Agarophyton chilensis ex Gracilaria chilensis
(C.J.Bird, McLachlan & E.C.Oliveira 1986)

El “pelillo”, es extraído desde el intermareal y submareal, es una de las principales fuentes de ingresos para algunas comunidades costeras. Habita fondos duros y fangosos en bahías y zonas estuarinas. Se encuentra hasta los 25 m de profundidad. Posee un ciclo de vida Haplodiplóntico Trifásico Isomórfico. Esta alga es utilizada para la extracción de agar, compuesto químico importante en procesos productivos para la industria farmacéutica y alimentaria. El precio promedio transado en playa es de $50 /Kilo húmedo.
Técnicas de Cultivo para el pelillo
Las técnicas de cultivo mas utilizadas son: la siembra directa, indirecta o el cultivo suspendido (Fig.1).
El método de cultivo directo consiste en sembrar talos individuales o “matas” de pelillo en el fondo del mar, mediante horquetas o herramientas con las cuales sea posible hacer surcos sobre sustratos blandos. Esta técnica se puede realizar buceando, en botes o directamente en sustrato por el pescador.
Figura 1. Técnica de siembra directa: (A) Buzo (B) bote (C) pescador (D) pradera sembrada. FUENTE: PROYECTO FIPA 2017-56 “Repoblamiento de Gracilaria chilensis en 5 AMERBs de la Región del Biobío”.
Los métodos de cultivo indirecto, dependen de alguna estructura de soporte que los mantega cerca o fija al fondo como lineas (cuerda a media agua), mangas de polietileno (chululos), piedras (matapiedras) o estacas donde se disponen los talos de pelillo. Sin embargo, las mangas de polietileno se dejaron de utilizar porque constituían una fuente de contaminación que se acumulaba en las playas luego de la cosecha.
Figura 2. Técnica de cultivo indirecto. (A) cuerda con talos recien sembrados (B) cuerda con talos ya crecidos (C) piedras con talos adheridos (D) magas de polietileno con talos adheridos. FUENTE: PROYECTO FDI-CORFO Estrategias competitivas de mejoramiento productivo del cultivo del “pelillo” (Gracilaria chilensis) en la X Región 01CR3PT-13.
En ambos métodos de cultivo se utilizan talos adultos (tejido vegetativo) como medio de propagación y crecimiento
En cultivos suspendidos se distinguen dos tipos:
Método vegetativo de propagación, consiste en colocar talos individuales o manojos de pelillo en cuerdas (encordado) y luego colocar estas cuerdas atadas horizontalmente a estacas enterradas.
Método de cultivo mediante talos generados a partir de esporas; aquí es necesario el apoyo de instalaciones mas costosas como un Laboratorio y Hatchery como etapa previa antes de trasladar los talos al cultivo en el mar.
Etapa Laboratorio y Hatchery - Método mediante esporas
En esta etapa se seleccionan los talos reproductivos desde el medio natural y se trasladan al hatchery, en donde se limpian y aplican estímulos a través de la desecación para provocar la liberación de esporas (esporulación). Las esporas obtenidas se siembran sobre estructuras como bastidores y luego de 2 a 3 meses se generan cuerdas con plántulas que luego son trasladadas a un sistema de pre-crecimiento en el mar. Estos sistemas pueden ser de fondo o de media agua.

Figura 3. (A) Cultivo horizontal de fondo (B) Cultivo suspendido vertical.
Etapa de Mar
Las cuerdas con plántulas que son trasladadas al mar para pre-crecimiento se instalan atadas a estacas enterradas en el fondo en líneas de 10 m longitud y separadas 0.5 m entre sí. O a sistemas de cuerdas verticales ayudadas de boyas y pesos para mantener la posición a media agua, como muestra la Figura 4. Estas algas pueden cultivarse en el mar hasta su cosecha o bien esperar un desarrollo temprano (cuando alcanzan 20 cm) para luego sacarlas y llevarlas nuevamente al Hatchery donde se entrelazan a otra cuerda para ser trasladadas a diferentes centros de cultivo.
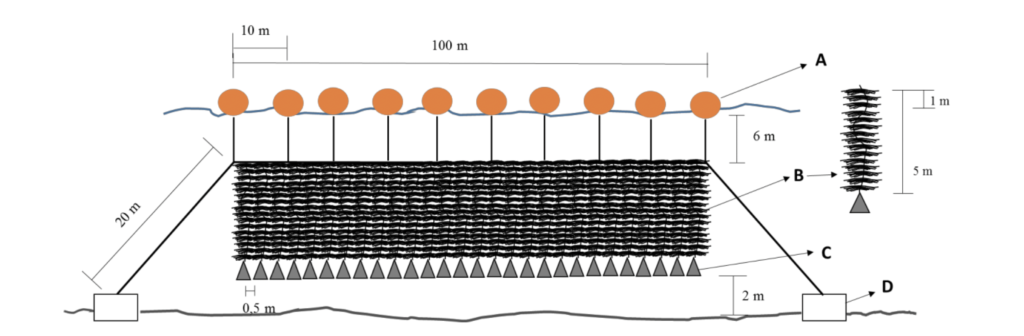
Figura 4. Sistema de cultivo a media agua, vertical. (A) Boyas (35 l), (B) Cuerda de cultivo, (C) potalas y (D) Bloques de hormigón (500 kg

Tabla 1. Producciones de Pelillo propuestos por diferentes estudios realizados en el mar. / FUENTE: Saavedra S, Henríquez L, Leal P, Galleguillos F, Cook S, y Cárcamo F. (2019) – Cultivo de Macroalgas: Diversificación de la Acuicultura de Pequeña Escala en Chile. Convenio de Desempeño, Subsecretaría de Economía y Empresas de Menor Tamaño. Instituto de Fomento Pesquero. 106 pp.
Factores importantes a considerar en el cultivo
Presencia de epífitos: tanto en los métodos de siembra directo e indirecto (por ejemplo, Rhizoclonium spp. Polysiphonia spp, Ceramium spp).
Características del sustrato para la siembra: en algunos casos es posible que se produscan embancamientos que pude generar la pérdida de la biomasa algal y la inversión por compra de semillas.
Cultivo de talos vegetativos (cultivo sin cruzamiento sexual): esta práctica, lleva a la selección involuntaria de variedades que, por falta de cruzamiento, pierden atributos de sobrevivencia por bajo nivel de intercambio genético. Esta situación puede disminuir la capacidad de adaptación biológica a los cambios medioambientales o enfermedades de las algas, generando tanto una baja sobrevivencia.
“Chasca” Gelidium spp

En Chile, Gelidium chilense, Gelidium lingulatum y Gelidium rex, son especies económicamente importantes. Por su parte, G. lingulatum se extiende desde el centro al sur de Chile (33 a 41°S), mientras que las otras dos especies se distribuyen desde Chile central hasta el centro del Perú (35 a 14°S).
Todas estas especies se distribuyen en la zona intermareal baja, a lo largo de roqueríos expuestos al oleaje y cohabitando en la misma área intermareal (G. lingulatum y G. chilense). Por su parte, G. rex se ubica en el intermareal bajo hasta el submareal alto formando algunas veces cinturones o bandas, frecuentemente bajo la sombra y protección del alga parda Lessonia spp y asociadas a bancos de arena. Sin embargo, también es común registrar la presencia de G. lingulatum asociada a las algas pardas de las zonas expuestas de los roqueríos. Esta alga se usa como materia prima para la extracción de agar de alta calidad para la industria alimenticia y en biotecnológica.
Figura 3. Morfología de especies de Gelidium: (A) G. lingulatum, (B) G. chilense y (C) G. rex. / FUENTE: Otaíza, R.D. y J. Cáceres, 2017. Manual de una técnica para el repoblamiento de la chasca delgada, Gelidium lingulatum (Kützing (Rhodophyta, Gelidiales), en roqueríos intermareales, Región del Biobío. Proyecto FONDEF-REGIONAL D13R20031. 40 pp.
Técnica de cultivo de la chasca delgada
Etapa Laboratorio y Hatchery - Método mediante esporas
En Chile, el cultivo de estas especies aun se encuentra en estado experimental. Se han probado dos técnicas de cultivo; mediante esporas y mediante la fijación de trozos vegetativos a un sustrato calcáreo (valvas de ostiones u otro bivalvo). Y en repoblamiento, se ha intentado con talos reproductivos y vegetativos de G. lingulatum sembrados directo al sustrato rocoso en donde habitan estas especie.
En ambas técnicas es necesario obtener el material reproductivo fresco desde praderas naturales. En la primera técnica el tejido es trasladado al laboratorio (en condiciones de humedad y baja temperatura controlada) para luego seleccionar los talos y comenzar con el proceso de esporulación (liberación de esporas). La esporulación se gatilla mediante un tratamiento de shock térmico (16°C en oscuridad durante 24 horas). Posteriormente las algas tratadas son depositadas dentro de mallas y flotando en estanques de 0.5 m3, en el fondo del estanque se colocan sustrato calcáreo; la idea es que el sustrato reciba una lluvia de esporas desde una altura de 30 cm. La inoculación del sustrato (sembrado de esporas) se realiza durante 48 horas. Posteriormente las algas son retiradas y el sustrato inoculado es montado en un sistema de suspensión donde el sustrato es separado mediante pequeños trozos de PVC y colgado de forma vertical dentro de los estanques en hatchery, las condiciones de cultivo son 14±2°C y medio de cultivo Provasoli (Fig. 4).
La segunda técnica en adosar las frondas a un sustrato calcáreo mediante una malla de plástico. Al igual que en el caso anterior se monta un sistema de suspensión donde se cuelgan las valvas en estanques con las mismas condiciones anteriores más aireación y circulación de agua de mar (Fig.4).

Figura 4. Sustratos calcáreos en los cuales se siembran los talos de Gelidium spp. y estanques de recirculación y aireación constante.
Etapa de Mar
El primer sistema desde el Hatchery es trasladado a un sistema de cultivo suspendido en el mar a una profundidad aproximada de 3 metros durante 150 días. En dos meses, los talos alcanzan una talla de 4,15 cm.
El segundo sistema (algas adosadas a material calcáreo mediante malla plástica) se trasladan al mar a los 80 días después de iniciado el cultivo. A los tres meses y medio, se obtienen plantas de 6,1 cm.
Factores importantes a considerar en el cultivo
Si bien se ha propuesto el cultivo en estanques como una opción para Gelidium spp, aun no ha sido posible obtener la cantidad suficiente de esporas para el cultivo de esta especie. Dado que es necesaria una gran cantidad de biomasa del alga para la esporulación. Además, las tasas de crecimiento en laboratorio no han sido óptimas, esta situación hace poco rentable el cultivo en hatchery.
Otra dificultad para el cultivo vegetativo de Gelidium (mediante fragmentación) es la necesidad de una gran cantidad de plántulas que deben obtenerse a partir de praderas naturales, lo que hace necesaria la presencia de una pradera ya establecida que pueda alimentar la actividad de cultivo sin verse mermada de manera crítica.

Tabla 2. Producciones de Gelidium propuestas por estudios realizados en el mar / FUENTE: (A) Saavedra S, Henríquez L, Leal P, Galleguillos F, Cook S, y Cárcamo F. (2019) – Cultivo de Macroalgas: Diversi cación de la Acuicultura de Pequeña Escala en Chile. Convenio de Desempeño, Subsecretaría de Economía y Empresas de Menor Tamaño. Instituto de Fomento Pesquero. 106 pp.
Carragenófitas
A este grupo pertenecen las macroalgas rojas productoras de carrageninas. Las carrageninas son polisacáridos naturales capaces de formar dispersiones coloidales viscosas o geles en medio acuoso y/o lácteo.
“Luga Roja” Gigartina skottsbergii Setchell & N.L.Gardner 1936
Figura 11. “Luga Roja” Gigartina skottsbergii Setchell & N.L.Gardner 1936
Esta especie presenta frondas laminares de textura lisa y rugosa, muy gruesas y abundantes de color rojo. Crece en ambientes protegidos adherida a rocas o sustratos duros, por medio de rizoides desarrollándose en forma horizontal sobre el substrato. Es una especie endémica y se extiende desde Niebla hasta el Cabo de Hornos (Avila et al., 1999; Westermeier et al., 1999). Generalmente está asociada a bosques de “huiros” pero también se observan praderas independientes. Es una especie de aguas templadas-frías, su rango de tolerancia a la temperatura alcanza hasta los 14°C como máximo y 4°C como mínimo. Se fija al sustrato gracias a un disco de fijación pequeño, y puede alcanzar la fronda completa hasta 1,5 m. Esta macroalga es importante porque se obtienen carragenanos que son utilizados por diversas industrias, principalmente la alimenticia.
El cultivo de luga roja se ha probado tanto en fase experimental como piloto en el mar, obteniendo resultados a largo plazo, debido a su prolongado periodo de crecimiento en el ambiente natural. Los microtalos no forman parte de la biomasa cosechable de la pradera sino al menos transcurridas dos temporadas de crecimiento.
Técnicas de Cultivo para la Luga Roja
Etapa Laboratorio y Hatchery - Método mediante esporas
El cultivo comienza con la recolección de frondas reproductivas, las cuales pueden ser cistocárpicas o tetraspóricas. Dado el diferente tipo de carragenano que poseen las fases del ciclo de vida se deben seleccionar frondas con cistocarpos maduros para obtener esporas, al germinar generarán frondas tetraespóricas, que produciran carragenina tipo “Kappa”. Por el contrario, si se utilizan frondas tetraespóricas maduras para obtener esporas, ellas originarán gametofitos masculinos y femeninos que producen carragenina del tipo “Lambda”.
Las frondas se trasladan al hatchery en contenedores térmicos en condiciones controladas de humedad y baja temperatura, donde se separan por fases, luego se lavan con agua de mar filtrada y se deshidratan con papel absorbente. Dede las algas secas se generan algunas manchas de color marrón en el papel, las frondas deben volver a hidratarse en baldes con agua de mar filltrada, momento en el cual liberan las esporas, esto se conoce como tratamientro de shock-osmótico. Esta solución de espóras se vierte en estanques previamente preparados con bastidores o alguna estructura similiar, que son estructuras de PVC donde se enrollan entre 60 a 70 m de cuerda de 2 mm de diámetro. Estos estanques se mantienen aproximadamente por 15 días sin recambio de agua, para que las esporas puedan fijarse al sustrato y comenzar su desarrollo hacia un juvenil. Transcurridos 3 a 5 meses, se observan pequeñas plántulas adheridas a la cuerda. Durante este periodo se utiliza fertilizante foliar para suplir las necesidades nutricionales. Por último, las cuerdas con las plántulas adheridas son transportadas en condiciones de humedad y baja temperatura para el cultivo en el mar.
Etapa de Mar
Desde el hatchery se trasladan las plántulas al sistema de cultivo suspendido para comenzar su crecimiento en el mar. El sistema de cultivo suspendido consiste en utilizar trozos de frondas vegetativas y reproductivas para elaborar “reinales” (los reinales se instalan de forma vertical sobre el long line) con hasta un kilo de trozos de frondas. Con la ayuda de una una “potala” o peso se logra mantener la posición vertical en la columna de agua. Se recomienda que la instalación del sistema sea durante los meses de agosto o septiembre para permitir el desarrollo óptimo en los meses de primavera y verano, que es en donde se ha reportado el mayor crecimiento de esta especie. Por último, las líneas instaladas se deben revisar y limpiar periódicamente para así evitar la aparición de epibiontes (fouling) que puedan interferir con el cultivo. La cosecha se realiza después de dos años, sin embargo, luego de 5 a 6 meses se puede doblar la biomasa inicial, para asegurar el éxito de la cosecha final.

Figura 12. Cultivo suspendido individual de Gigartina skottsbergii. / FUENTE: Saavedra S, Henríquez L, Leal P, Galleguillos F, Cook S, y Cárcamo F. (2019) – Cultivo de Macroalgas: Diversificación de la Acuicultura de Pequeña Escala en Chile. Convenio de Desempeño, Subsecretaría de Economía y Empresas de Menor Tamaño. Instituto de Fomento Pesquero. 106 pp.
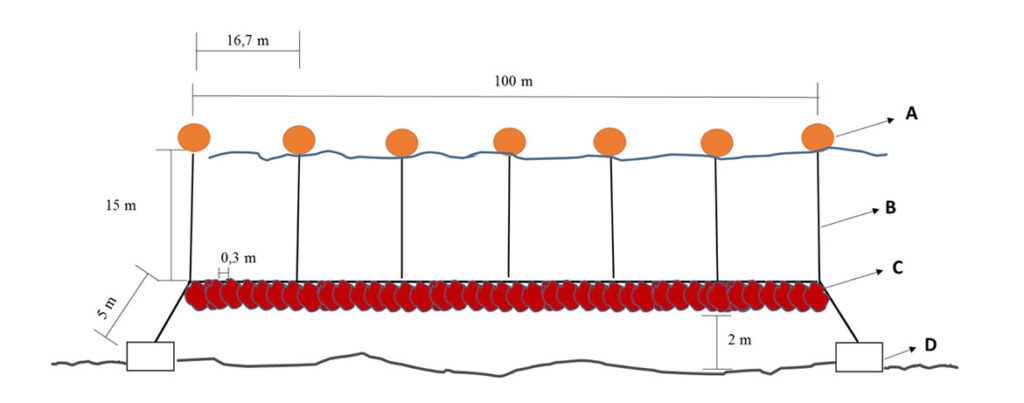
Figura 13. Esquema de sistema de cultivo suspendido de G. skottsbergii. (A) Boyas (35 l), (B) Cuerda amarre de boya, (C) Cabo de fondeo y línea madre y (D) Bloques de hormigón (500 kg).
Factores importantes a considerar en el cultivo
El mas importante si duda es que el crecimiento de esta especie es lento. Aproximadamente dos años hasta obtener individuos aptos para la cosecha. Además, existen pocos hatcheries autorizados que puedan producir cuerdas con plántulas adheridas a partir de esporas. La mantención y limpieza de las líneas de cultivo es fundamental.
El problema que se ha registrado en la etapa de hatchery es que existe evidencia de una alta mortalidad durante el desarrollo temprano del cultivo de esporas (cercano al 95%). Esto sin duda puede generar problemas en la inoculación eficiente de líneas para un cultivo comercial relativamente sustentable.

Tabla 4. Produccion de G. skottsbergii en la etapa de mar / FUENTE: (A) Saavedra S, Henríquez L, Leal P, Galleguillos F, Cook S, y Cárcamo F. (2019) – Cultivo de Macroalgas: Diversi cación de la Acuicultura de Pequeña Escala en Chile. Convenio de Desempeño, Subsecretaría de Economía y Empresas de Menor Tamaño. Instituto de Fomento Pesquero. 106 pp.
Sarcothalia crispata (Bory) Leister (Luga Negra)

Figura 14. Morfología y habitat natural de S. crispata en la zona intermareal baja. / FUENTE: Saavedra S, Henríquez L, Leal P, Galleguillos F, Cook S, y Cárcamo F. (2019) – Cultivo de Macroalgas: Diversificación de la Acuicultura de Pequeña Escala en Chile. Convenio de Desempeño, Subsecretaría de Economía y Empresas de Menor Tamaño. Instituto de Fomento Pesquero. 106 pp.
Las plantas presentan una o más láminas de color pardo-rojizas las que alcanzan longitudes de hasta 1 m de largo y 60 cm de ancho aproximadamente. Sin embargo, es muy común observar láminas de 40 a 50 cm de largo. Crece a temperaturas que fluctúan entre 9 a 15°C. Su sistema de adhesión al sustrato es a través de un disco basal perenne, del cual nacen proliferaciones que se asemejan a cilios o papilas por los bordes del disco. En el centro de este, emerge un estipe principal que soporta la lámina central. El hábitat de esta especie corresponde a la zona intermareal baja hasta la zona submareal somera, hasta 10 m de profundidad sobre sustrato rocoso y piedra. Esta alga se distribuye desde Valparaíso a Tierra del Fuego. Se utiliza como materia prima para la extracción de carragenina.
Técnicas de Cultivo para la Luga Negra
Etapa Laboratorio y Hatchery
En general el cultivo de luga negra es similar al de Luga roja. Etapa Laboratorio y Hatchery
Primero se recolectan frondas reproductivas, se separan las por fases (gametofoto y esporofito) para asi obtener distintos tipos de carragenanos (ver mas arriba). Luego estas se deshidratan e hidratan, dandoles un shock-osmótico, lo que permite la liberación de las esporas para obtener la solución de suspensión. Y por ultimo, se siembran las esporas sobre los bastidores o estructuras similares que se encuentran en los estanques en el hatchery.
En 6 meses esta especie debiera encontrarse en condiciones de cosecha. Los requerimientos nutricionales de los primeros estados de vida de S. crispata en laboratorio se suplen con medio de cultivo Provasoli se utiliza un fertilizante foliar agrícola para disminuir los costos de producción masiva. También se puede utilizar nutrientes en la forma de nitrato de amonio y solución de urea para mejorar el crecimiento de esporas (tetrásporas).

Figura 15. Resumen de la etapa de hatchery de S. crispata. (A) Recolecccion de esporas y solución de suspensión de esporas. (B) sembrado de esporas en bastidores en un estanque con recirculación de agua y tempratura regulada. (C) bastidores con plántulas en desarrollo. / FUENTE: Saavedra S, Henríquez L, Leal P, Galleguillos F, Cook S, y Cárcamo F. (2019) – Cultivo de Macroalgas: Diversificación de la Acuicultura de Pequeña Escala en Chile. Convenio de Desempeño, Subsecretaría de Economía y Empresas de Menor Tamaño. Instituto de Fomento Pesquero. 106 pp.
Etapa de Mar
Se instalan en un sistema de cultivo suspendido de manera vertical, utilizando potalas para mantener la linea fijas y de manera vertical. Es recomendable y dependiendo del sector y de las condicioens de transparencia de algua probar la instalación de estas estructuras a diferentes profundidades. Se ha reportado que a 2 m de profundidad se pueden alcanzar tallas cosechables mayores de 10 cm luego de 3 meses de cultivo. A 3.5 m de profundidad se alcanzaron tallas entre 7 cm a 15 cm luego de 6 meses de cultivo, considerando 1 mes de cultivo en hatchery.
Factores importantes a considerar en el cultivo
La calidad del material reproductivo es fundamental, de esta manera, se obtiene una buena esporulación (esporas viables) lo que permite obtener altas densidades de plántulas. Un buen sistema de filtración y esterilización del agua es importante en un hatchery para la salud de las esporas y juveniles. Uno de los factores que pueden afectar al crecimiento de S. crispata es la radiación UVB. Se ha observado que la exposición de plantas (así como G. skottsbergii) a altos niveles de radiación UVB en altas latitudes (Región de Magallanes) provocan un crecimiento lento.

Tabla 5. Producción de S. crispata en la etapa de cultivo en mar. / FUENTE: (A) Saavedra S, Henríquez L, Leal P, Galleguillos F, Cook S, y Cárcamo F. (2019) – Cultivo de Macroalgas: Diversi cación de la Acuicultura de Pequeña Escala en Chile. Convenio de Desempeño, Subsecretaría de Economía y Empresas de Menor Tamaño. Instituto de Fomento Pesquero. 106 pp.

Figura 16. Estructuras de cultivo suspendido de S. crispata en etapa de mar a travésd e una potala. Se observa la malla plástica que ayuda a mantener el tejido reproductivo y la piedra o peso, que ayuda a mantener la verticalidad de la estructura por gravedad. / FUENTE: Saavedra S, Henríquez L, Leal P, Galleguillos F, Cook S, y Cárcamo F. (2019) – Cultivo de Macroalgas: Diversificación de la Acuicultura de Pequeña Escala en Chile. Convenio de Desempeño, Subsecretaría de Economía y Empresas de Menor Tamaño. Instituto de Fomento Pesquero. 106 pp.
“Luga cuchara” Mazzaella laminarioides (Bory de Saint-Vincent)

Figura 21. Morfología de frondas reproductivas de Luga cuchara. (A) Esporofito con soros tetraesporangiales y (B) Gametofito femenino con cistocarpos. FUENTE: Otaíza, R.D. y J. Cáceres, 2015. Manual de una técnica para el repoblamiento de la luga corta, Mazzaella laminarioides (Bory) Fredericq (Rhodophyta, Gigartinales), en roqueríos intermareales, Región del Biobío. Proyecto FONDEF-HUAM AQ12I0004. 40 páginas.
Presenta un disco basal perenne en forma de costra discoide que se adhiere al sustrato. Desde esta estructura emergen estacionalmente un número variable de láminas erectas (Santelices 1989, Hoffmann & Santelices 1997). Las frondas son de color pardo, café claro a amarillo, su tamaño puede alcanzar hasta los 30 cm de longitud, crece en el intermareal rocoso y en pozas intermareales. Su distribución va desde Coquimbo a Tierra del Fuego y presenta un ciclo de vida Haplodiplóntico Trifasico Isomórfico. Al igual que la mayoría de las macroalgas carragenófitas, presenta un ciclo de vida Trifásico Isomórfico donde se observa una fase gametofítica (ambos sexos y reproducción sexual), una fase carposporofítica y una fase tetrasporofítica. Durante la fase de reclutamiento son capaces de presentar coalescencia con otros organismos de la misma especie lo que les permite alcanzar mayor tamaño para poder sobrevivir. Generalmente se encuentra en cordones o parches, tanto en roqueríos protegidos como expuestos del intermareal medio bajo. Actualmente hay evidencia molecular que indica que la luga corta corresponde a tres especies que se distribuyen latitudinalmente en Chile. Sin embargo, aún no se ha determinado el nombre.
Esta especie se extrae principalmente para la obtención de carragenanos, que es utilizado como agente espesante o gelatinizante en productos lácteos y cosméticos. Los precios se registran sólo para alga fresca, a $770 /Kilo.
Para esta especie se han generado experiencias de cultivo de juveniles en laboratorio (producción de esporas), mantención y crecimiento. Esto con el objetivo de repoblación o restauración de poblaciones naturales.
Técnica de repoblamiento para luga cuchara
Se ha desarrollado de manera experimental una técnica que consiste en la inoculación de esporas en sustrato artificial e incubación de juveniles en laboratorio, seguida por su trasplante a roqueríos. Este procedimiento consisten la siembra de sustratos con juveniles trasplantados en unidades de siembra o directamente con fragmentos de frondas reproductivas (cistocárpicas o tretraespóricas) a perforaciones taladradas en las rocas. El trabajo es sencillo, particularmente si los roqueríos están hechos de rocas blandas. Sin embargo, si el sustrato es de piedra caliza u otra conformación dura, el esfuerzo de siembra se hace mayor. La cantidad de perforaciones depende del esfuerzo que se quiera realizar. Si los sitios elegidos son los apropiados y la siembra de esporas es exitosa, se obtienen individuos juveniles a los 6 u 8 meses, dependiendo la época del año en que se realice la siembra. No existen reportes de producciones en mar.
Los factores más importantes para la siembra de las unidades de transplante es la correcta selección del sitio, en donde se debe considerar: tipo de sustrato, altura intermareal, exposición al oleaje, flujo de agua, exposición al sol, pendiente de la superficie de siembra, presencia de arena y presencia de otros organismos.
Factores importantes a considerar en el cultivo
El cultivo se encuentra en fase experimental.Sin embargo se debe cnsiderar la calidad del tejido recolectado. Las fases reproductivas y la época del año en la cual se recolecten las frondas. Ya que se ha reportado que la abundancia y madurez de las frondas según la fase, varía estacionalmente.

Figura 22. Inoculación (siembra) de esporas en una esponja, que es utilizada como sustrato para generar unidades de siembra. / FUENTE: Otaíza, R.D. y J. Cáceres, 2015. Manual de una técnica para el repoblamiento de la luga corta, Mazzaella laminarioides (Bory) Fredericq (Rhodophyta, Gigartinales), en roqueríos intermareales, Región del Biobío. Proyecto FONDEF-HUAM AQ12I0004. 40 páginas.

Figura 23. (A) Esquema de dispocisión espacial de las unidades de siembra en terreno. (B) Unidades de siembra instaladas en el sustrato rocoso.

Figura 24. (A) Unidades de siembra instaladas en el sustrato rocoso con fragmentos reproductivos (en este caso, frondas cistocárpicas) de M. laminarioides. (B) Crecimiento de luego de 8 meses de las unidades de siembra en las perforaciones realizadas en la roca.
“Chicorea de mar” Chondracanthus chamissoi (C.Agardh) Kützing

Figura 25. Morfología y habitat natural de C. chamissoi.
Las frondas poseen una morfología muy variable, son aplanadas de consistencia membranosa muy ramificada de color rojizo a café rojizo iridiscentes bajo el agua. Su tamaño llega hasta los 50 cm. Su hábitat corresponde a la zona intermareal y submareal, hasta 10m de profundidad, creciendo sobre rocas y bolones en zonas protegidas del oleaje y eventualnete cubiertas por arena. En Chile se distribuye desde Iquique hasta Chiloé y presenta un ciclo de vida Haplodiplóntico Trifasico Isomórfico.
C chamissoi es un alga roja usada para la extracción de carragenanos. Sin embargo, en los últimos años se ha exportado como alga para consumo humano en el mercado asiático, ya que es rico en vitaminas y proteínas vegetales. Esta situación ha favorecido las iniciativas de cultivo y manejo. Los precios que se registran para el alga fresca varían entre $350 y $700 /Kilo.
Tecnica de cultivo de la chicorea de mar
El cultivo comienza en la etapa de laboratorio, en donde se realizan las actividades de esporulación; en hatchery, se inoculan los sustratos artificiales o bien se preparan (selección y limpieza) las frondas por fases para ser encordadas. Por último, los talos son trasladados al mar e instalados sobre long-lines donde las plántulas crecen hasta el periodo de cosecha.
Existen diferentes métodos para el cultivo de Chicorea de mar; entre los que se encuentran (a) la reproducción sexual por esporas o esporocultivo, (b) la propagación vegetativa y (c) la fijación de discos secundarios (FDS).
(A) El esporocultivo:
Requiere de macroalgas fértiles (cistocárpicas o tetraspóricas), extraídas desde praderas naturales en buen estado. Luego se obtienen esporas para sembrarlas sobre sustratos artificiales. Por último, después de un tiempo de incubación se obtienen juveniles (1- 2 mm de altura) que pueden ser trasladados hacia la etapa de mar para su crecimiento hasta la cosecha.

Figura 26. Etapa de cultivo de esporas de C. chamissoi. sembradas en bastidores hasta crecimiento de juveniles. Los estaques deben contar con recirculación de agua de mar y aireación constante. / FUENTE: Avila M, G Aroca, R Riquelme, D Rodríguez, A Grünewald. 2018. MANUAL CULTIVO DEL ALGA COMESTIBLE: CHASCA o CHICORIA DE MAR Chondracanthus chamissoi. Serie Programa Educativo Participativo para la Pesca Artesanal. V Cultivo de chasca-chicoria de mar. 30 pp.

Figura 27. Resumen del cultivo de C. chamissoi. En la etapa de hatchery. / FUENTE: Juan Macchiavello A. & Cristian Bulboa C (2013). Manual de Cultivo de Chondracanthus chamissoi (Chicorea de Mar). “ALTERNATIVAS TECNOLÓGICAS PARA EL CULTIVO DE C. chamissoi EN LA ZONA NORTE DE CHILE A PARTIR DE DISCOS DE FIJACIÓN SECUNDARIA” CODIGO AQ08I-1028, 24 pp.
(B) El método de propagación vegetativa:
Utiliza trozos de frondas vegetativas (infértiles) y reproductivas, que son entrelazadas en cuerdas de polipropileno y mantenidas en sistemas de cultivo a diferentes profundidades.
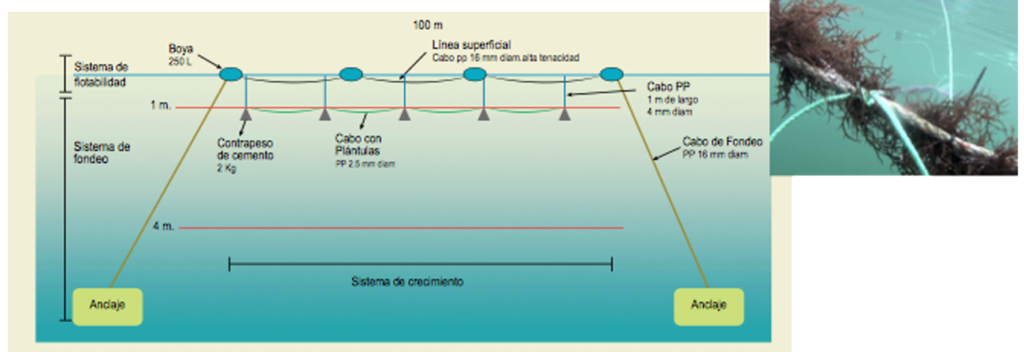
Figura 28. Sistema de cultivo suspendido de de C. chamissoi en la etapa de mar.
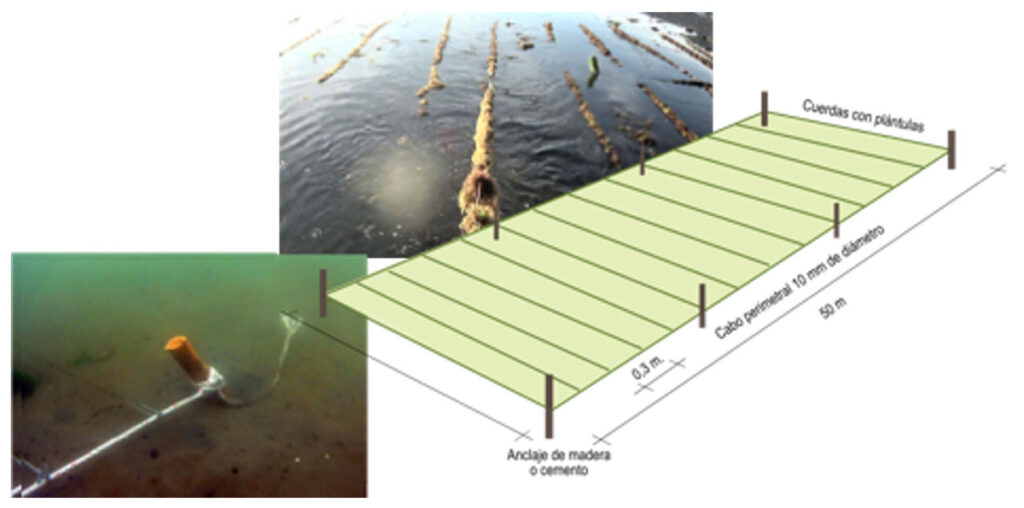
Figura 29. Sistema de cultivo de fondo de de C. chamissoi en la etapa de mar. / FUENTE: Avila M, G Aroca, R Riquelme, D Rodríguez, A Grünewald. 2018. MANUAL CULTIVO DEL ALGA COMESTIBLE: CHASCA o CHICORIA DE MAR Chondracanthus chamissoi. Serie Programa Educativo Participativo para la Pesca Artesanal. V Cultivo de chasca-chicoria de mar. 30 pp.
(B) El método de fijación de discos secundarios (FDS):
también llamada de re-adhesión de fragmentos de Chicorea, es un mecanismo importante y eficiente para la regeneración de biomasa, para la mantención de poblaciones naturales y el desarrollo de cultivos. Esta técnica Requiere de: 1) Obtención de tejido desde el medio natural y selección de plántulas 2) Limpieza, 3) Mantención de macroalgas en estanques, 4) Corte de macroalgas (fragmentación), 5) Mantención en hatchery, 6) Fijación de tejido sobre sustrato artificial, 7) Siembra en sistema suspendido (línea de cultivo tipo long-line), 8) Monitoreo, mantención y cosecha.
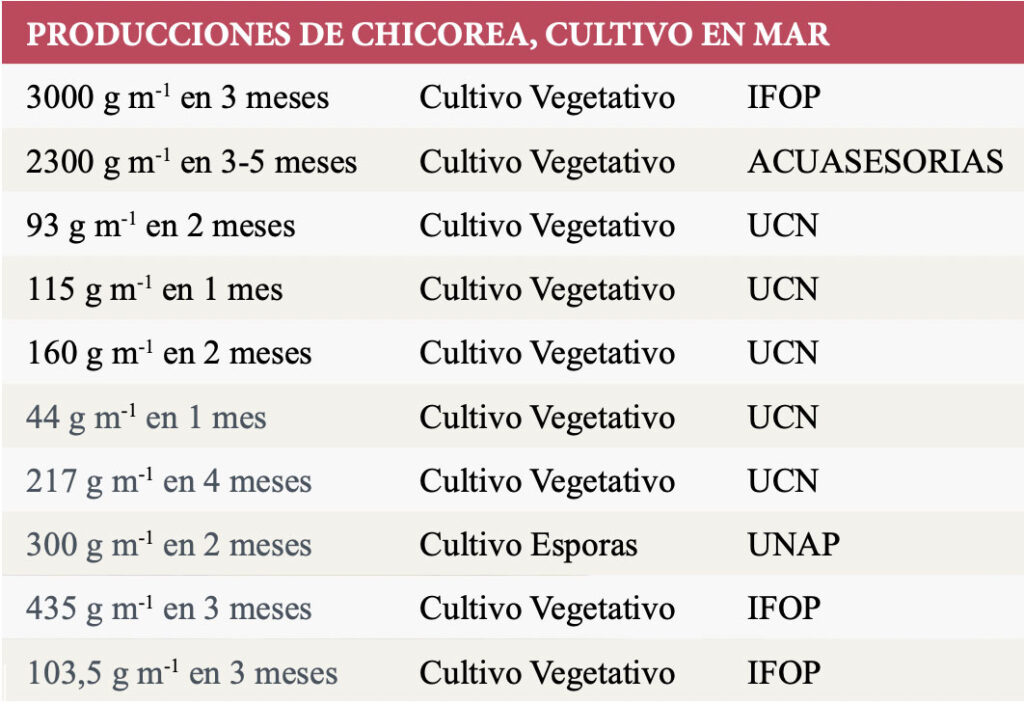
Tabla 6. Producción de C. chamissoi en la etapa de mar. Los niveles de producción dependen del tipo de cultivo. Las producciones varían entre 44 g m ̄1 y 3000 g m ̄1, durante 1 a 5 meses de cultivo. / FUENTE: (A) Saavedra S, Henríquez L, Leal P, Galleguillos F, Cook S, y Cárcamo F. (2019) – Cultivo de Macroalgas: Diversi cación de la Acuicultura de Pequeña Escala en Chile. Convenio de Desempeño, Subsecretaría de Economía y Empresas de Menor Tamaño. Instituto de Fomento Pesquero. 106 pp.
Factores importantes a considerar en el cultivo
Existen pocos Hatcheries autorizados que se dediquen al abastecimiento de cuerdas con semillas, por lo tanto no existe una gran capacidad productiva y es crítica.
Se han reportado los siguinetes factores criticos a considerar en la etapa de mar: la caliad del tejido reproductivo, la profundidad en que se realiza el cultivo, momento estacional del ingreso al mar (preferentemente en otoño-invierno) y la mantención de las líneas y sistemas de cultivo. Además de considerar al igual que en cualquier cultivo de macroalgas, la presencia durante primavera-verano de epifitos y epibiontes que hacen que la biomasa cosechable disminuya.
Otras algas extraidas con frecuencia
“Luche” Pyropia spp. (ex Porphyra spp)

Figura 32. Morfología y habitat natural del Luche. Se destaca la coloración rojiza de sus bordes ondulados, evidencia de un estado de maduración de sus láminas.
Pyropia o ex Porphyra es un género de alga roja comestible que tiene varias especies, perteneciente al orden Bangiales que se distribuye en Perú, Chile y Argentina, también se puede encontrar en otros lugares del mundo como en Australia, Nueva Zelandia, Japon, China, Canadá, es una especie cosmopolita (Guiry & Guiry 2015). Se conoce con el nombre común de “luche” y “nori” o “laver” en inglés. Esta especie es de morfología muy variable, puede tener frondas de formas circulares, alargadas, ovaladas y en algunos casos puede tener los bordes lisos o lobulados. Las frondas son de color café amarillento o verde amarillento, en sus bordes a veces presenta una coloración rojiza cuando las frondas se encuentran reproductivas y maduras. Presenta una alta resistencia a la desecación. Crece en la zona intermareal fija a la roca a través de un disco de fijación, durante la baja marea queda expuesta a desecación y altas o bajas temperaturas, es una especie muy resistente a cambios. La presencia de talos en los roqueríos intermareales es estacional. Tienen un ciclo de vida complejo, Haplodiplóntico Heteromórfico, con presencia de una fase microscópica. La biología de este género ha sido extensamente estudiada por el valor económico de la especie y de la industria de maricultura para producción de nori desarrollada en Japón (Guiry & Guiry 2015).
Un estudio reciente de taxonomía molecular efectuado en la costa de Chile revela que al menos 16 especies pertenecerían a los géneros Porphyra y Pyropia; con excepción de Pyropia orbicularis todas las especies descritas en ese estudio serían nuevas para la
flora marina chilena. Esta alga ha sido tradicionalmente utilizada para el consumo humano y ocupa un lugar importante de la cocina tradicional del país y el mundo. Los precios en playa durante el año 2018 uctuaron entre $1000 y $1500 /Kilo húmedo.
Tecnica de cultivo del luche
El cultivo del luche se desarrolla en tres etapas principales: siembra de fase conchocelis, siembra de conchoesporas y crecimeinto en el mar.
Siembra de Conchocelis: Se debe obtener esporas, esto se logra induciendo a la fronda mediante desecación a liberar las esporas. Luego son sembradas sobre valvas de moluscos (preferentemente ostra chilena u ostra japonesa). Estas valvas se disponen en el fondo de los estanques de cultivo, de baja profundidad y una amplia superficie para disponer más conchas en el fondo. Se deben matener las condiciones óptimas de temperatura, salinidad, flujo fotónico y fotoperiodo tanto para el crecimiento como la maduración de la fase conchocelis en hatchery. Además, de la incorporación de nutrientes, recambio de agua y limpieza de los estanques para evitar contaminación por diatomeas y otras algas epifitas.
Siembra de conchoesporas sobre redes: se siembran redes con las esporas generadas por la fase conchocelis (conchoesporas). Las redes que se utilizan para sembrar estas esporas son especiales para el cultivo de luche (1,8 m ancho × 18 m largo; 30 cm de apertura de malla). Consiste en una malla doble, la cual tiene numerosos “bolsillos” dentro de los que se introducen conchas previamente inoculadas con fase conchocelis producidas en hatchery. Sobre esta malla doble se colocan 10 a 20 redes sobre las que se fijaran las conchosporas, envolviendo todo en una manga de polietileno. Esta estructura se tralada a un sistema suspendido en el mar para que las conchas liberen sus esporas y se fijen sobre las redes dentro de la manga de polietileno. Posteriormente, las redes inoculadas son sacadas de la manga de polietileno y trasladadas a los sitios de nitivos de cultivo en el mar.

Figura 32. Proceso de hatchery; mantención y siembra de espóras (A-B-C-D) . Sistema de cultivo suspendido en la etapa de mar del Luche (E). / FUENTE: Saavedra S, Henríquez L, Leal P, Galleguillos F, Cook S, y Cárcamo F. (2019) – Cultivo de Macroalgas: Diversi cación de la Acuicultura de Pequeña Escala en Chile. Convenio de Desempeño, Subsecretaría de Economía y Empresas de Menor Tamaño. Instituto de Fomento Pesquero. 106 pp.
Estapas de mar
Se instalan sistemas orientados perpendicularmente a la línea de costa, ocupando la franja de distribución intermareal que normalmente ocuparía el luche en condiciones naturales, amarradas a estacas a una altura que permita que experimenten los períodos de desecación e inmersión propios de un ciclo mareal, evitando así la presencia de fouling. Tambíen se conoce un siistema denominado semi flotante, consiste en colocar las redes con un sistema de argollas y flootadores a las estacas, permitiendo que las redes estén mayor tiempo sumergidas. La primera cosecha puede ser obtenida a los dos meses.

Figura 33. Sistemas de cultivo en la etapa de mar del Luche. Se observa que es necesaria que sean de baja profundidad simulando el habitat natural de esta especie en la zona intermareal. FUENTE: http://www.fao.org
Callophyllis variegata (Bory de Saint-Vincent) Kützing (Carola)

Figura 33. Morfología externa de C. variegata.
Esta alga roja que ha sido exportada para consumo a países del oriente. Conocida con el nombre común de “carola” se distribuye desde Antofagasta a Tierra del Fuego. Crece sobre sustrato duro en el submareal, entre los 0 y 15 m, junto a otras especies como Sarcothalia crispata (luga negra), en hábitats semi-expuestos o protegidos (Hoffmann & Santelices, 1997): También se puede encontrar asociada a especies de algas pardas que forman bosques submarinos, como Lessonia trabeculata y Macrocystis pyrifera.
De aspecto frágil, su morfología es variable, son frondas delgadas de color rojo intenso, consistencia membranosa y tamaño variable, hasta 30 o 40 cm. de alto. Las frondas son planas y tienen abundantes ramificaciones y ápices profusamente disectados, de bordes irregulares y con proliferaciones laterales que al crecer se dividen como los segmentos mayores de la fronda. Estructuras reproductivas prominentes, ubicadas en los márgenes de la fronda. Tetrasporangios solitarios y ubicados sobre la superficie del talo, solo visibles al microscopio. Posee un ciclo de vida Haplodiplóntico Trifásico Isomórfico.
Estudios recientes, realizados en la costa centro-sur de Chile, entre los 33° y 41°S, registraron una variedad de morfos que constituirían al menos tres entidades diferentes: C. variegata la especie tipo del género, C. concepcionensis y C. macrostiolata descritas como nuevas especies. Esta alga está destinada principalmente al consumo humano debido a su alto contenido de vitaminas, minerales, proteínas y carbohidratos. Los precios en playa varían entre los $400 y $500 /Kilo húmedo.
Tecnica de cultivo de la carola
El esporocultivo, es similar al de las otras macroalgas rojas. Se recolecta material reproductivo maduro que es trasladado en condiciones de tempratura y humedad controladas hacia el laboratorio. En el hatchery se seleccionan las frondas separando las fases (cistocárpicas y tetraspóricas), se lavan para eliminar impurezas y epífitos. Posteriormente se deshidratan utilizando papel absorbente durante un periodo no menor a 2 horas. Luego son trasladadas a baldes (20 a 40 litros) donde en el fondo se colocan redes. Se adiciona agua de mar filltrada y esterilizada. Las frondas permanecen por un periodo máximo de 48 horas. Durante este tiempo las esporas son liberadas, decantan y se fijan a la red. Por último estas redes son trasladadas a estanques de mayor volumen donde se mantienen por 6 meses para el crecimiento de juveniles. Durante este periodo se aplican nutrientes (abono foliar) y se realizan recambios de agua en forma semanal. Una vez que se reconocen individuos juveniles, estas redes son trasladadas al sistema de cultivo suspen dido en el mar. Se han probado cultivos a diferentes profundidades (3.5 m, 4 m y a 20 cm del fondo; esta última ancladas al sustrato natural).

Tabla 7. Producción de Carola en la etapa de mar. / FUENTE: (A) Saavedra S, Henríquez L, Leal P, Galleguillos F, Cook S, y Cárcamo F. (2019) – Cultivo de Macroalgas: Diversi cación de la Acuicultura de Pequeña Escala en Chile. Convenio de Desempeño, Subsecretaría de Economía y Empresas de Menor Tamaño. Instituto de Fomento Pesquero. 106 pp.
Factores importantes a considerar en el cultivo
Es fundamental, al igual que todos los cultivos, obtener una buena calidad del material reproductivo para conseguir una buena esporulación. Es recomendable material reproductivo de la epoca de primavera, ya que en otras las esporas no son viables. También, la la calidad del agua de los hatchery, la mantención y limpieza de las líneas de cultivo, son de gran importancia.
Algas Pardas (Phaeophyceae)
Alginófitas
A este grupo pertenecen las grandes macroalgas pardas que estan formando huirales y praderas, las cuales son esenciales como refugio y áreas de reclutamiento para peces e invertebrados marinos, muchos de importancia comercial. Estas especies producen ácido algínico, el cual es un polisacárido que forma parte de las paredes celulares que conforman el tejido del alga.
Las principales especies son:
Huiro (Macrocystis pyrifera)
Huiro negro (Lessonia berteroana-Lessonia spicata)
Huiro palo (Lessonia trabeculata)
Cochayuyo (Durvillaea antarctica-incurvata)
Antecedentes biológicos Algas Pardas
Pertenecen a la división Phaeophyta y están agrupadas en el orden Laminariales. Su talo o cuerpo está conformado por un disco adhesivo, estipes y láminas. El disco adhesivo o grampón permite mantener al alga adherida al sustrato fuertemente. Los estipes corresponden a la sección de forma tubular que soporta a las frondas vegetativas o reproductivas.
“Huiro flotador” Macrocystis spp. (pyrifera e intergrifolia)
El recurso Macrocystis pyrifera comúnmente conocido como huiro o sargazo, corresponde a individuos de gran tamaño que pueden medir sobre 30 m de longitud. Se adhieren al sustrato mediante un disco basal, el cual está formado por hapterios ramificados de hasta 1 cm de grosor, no fusionados entre si (Hoffmann & Santelices, 1997). Del disco nacen varios estipes, cilíndricos, que terminan en láminas largas, provistas de un aerocisto alargado basal. Los ejemplares de Macrocystis ocupan un hábitat rocoso y forman densos bosques submareales llegando incluso hasta 30 metros de profundidad y excepcionalmente hasta 80 m (Hoffmann & Santelices, 1997). El disco de fijación alberga a numerosas especies de invertebrados. Posee un ciclo de vida Haplodiplóntico Heteromórfico.
Esta alga ha sido utilizada en la agricultura como fertilizante, posteriormente se ha explotado para la extracción de alginatos, también como alimento para el cultivo de otras especies como el abalón, para la obtención de biocombustibles y últimamente como alimento humano (solo plantas juveniles) por lo cual su cultivo es importante.
Materia prima destinada principalmente para la industria de los alginatos. Desde el cultivo se ha tranzado para exportar a China a US$3/Kg (precio FOB) destinado para consumo humano cocido y salado.

Figura 37. Morfología externa y habitat natural de M. pyrifera
“Huiro negro” Lessonia spp

Figura 38. Morfología externa y habitat natural de L. spicata
Si bien en el pasado Lessonia nigrescens se conocía como una única especie distribuida a lo largo de toda la costa de Chile. Hoy gracias a estudios morfológicos (González et al 2012) y moleculares (Koch et al 2015), se conocen como dos especies cripticas nuevas; Lessonia berteroana y Lessonia spicata. Por su parte L. beteroana se distribuye desde Perú a Coquimbo y L. spicata de Coquimbo a Puerto Montt. Estas especies de huiro negro o chascón, pude alcanzar hasta los 6-7m de largo y presenta un disco adhesivo o grampón de hasta 50cm de diámetro, del cual emergen un número variable de estipes que se dividen de forma dicotómica en frondas o láminas de largos y anchos variados. Su hábitat principal es la zona intermareal baja y submareal somera. Posee un ciclo de vida Haplodiplóntico Heteromórfico.
“Huiro palo” Lessonia trabeculata Villouta & Santelices
El huiro palo, puede alcanzar en talla adulta largos de hasta 2.5m. Posee un disco adhesivo compacto, de lo cuál emergen un número variable de estipes, desde 1 a 30m de longitud. Sus láminas son aplanadas alcanzando hasta los 15cm de ancho. Su hábitat principal corresponde a la zona submareal rocosa hasta los 30m de profundidad. Su distribución geográfica va desde Antofagasta hasta geográfica va desde Antofagasta hasta Puerto Montt (Tala et al 2004). Posee un ciclo de vida Haplodiplóntico Heteromórfico.

Figura 39. Morfología externa y habitat natural de L. trabeculata.
Tecnica de cultivo de los huiros
Etapa Laboratorio y Hatchery- Método mediante esporas
Esta etapa comprende la esporulación, la germinación de las esporas y la formación de esporo tos juveniles en laboratorio o hatchery.
Se debe recolectar frondas o láminas fértiles (con soros) desde una pradera natural preferentemente durante el verano, y ser transportadas al laboratorio laboratorio en bolsas plásticas dentro de contendores en condiciones de temperatura controlada. En el laboratorio, las frondas son lavadas con agua de mar filtrada para eliminar epibiontes (organismos adheridos a las láminas), secadas con papel absorbente y depositadas en bolsas plásticas en una cámara de cultivo o refrigerador a 8°C en oscuridad.
Luego de 12 a 24 horas, las frondas son sometidas a un shock osmótico (hidratación) y de temperatura dentro de algún recipiente con agua de mar a temperatura y luz ambiente para iniciar la liberación de esporas (zoosporas).
La solución de agua de mar y esporas se deposita en un estanque, donde se siembran en sustratos adecuados (i.e cabos de polipropileno, Nylon, pvc etc) dispuestos en bastidores para la etapa de crecimiento o hatchery, con aireación y flujo de agua constante. O por otro lado, si se requiere mantener un stock de esporas o juveniles, se debe disponer de envases con esporas (zoosporas) y depositarlos en cámaras de cultivo hasta que ocurra la germinación, esto es cuando las esporas pierden sus flagelos. Las esporas germinadas dan origen a los gametofitos femeninos y masculinos, los que se fecundan y luego de alrededor de un mes comienza a crecer el esporofito juvenil.
Estos contenedores deben contener agua de mar enriquecida con medio algún medio de cultivo. El medio de cultivo (e.g., Provasoli) es una solución de nutrientes que facilita el desarrollo y crecimiento de esporas en condiciones favorables: Lessonia spicata- berteroana entre 10°-15°C; intensidad de luz 30-40 μmol m-2 s-1, L. trabeculata 17°C, 37 – intensidad de luz de 46 μmol m-2 s-1 y para el caso de M. pyrifera entre 12-16°C, intensidad de luz entre 40-60 μmol m-2 s-1, para todas las especies se recomienda un fotoperiodo de 16:8 h (luz: oscuridad).
Existe otro método de cultivo llamado free-floating, que consiste en una solución de esporas, en donde se obtienen esporofitos juveniles que son cultivados en agua de mar enriquecida con aireación y agitación constante. Los juveniles flotan libres dentro de botellas de 10 litros; a medida que los esporofitos crecen el volumen del contenedor debe ir aumentando hasta ser trasladados al hatchery.

Figura 40. Estado reproductivo de láminas de (A) M. pyrifera y L. berteroana. Se observa en ambos casos que la coloración más obscura en la lámina es característica de la presencia de esporofilas (soros esporangiales). / FUENTE: (A) Saavedra S, Henríquez L, Leal P, Galleguillos F, Cook S, y Cárcamo F. (2019) – Cultivo de Macroalgas: Diversi cación de la Acuicultura de Pequeña Escala en Chile. Convenio de Desempeño, Subsecretaría de Economía y Empresas de Menor Tamaño. Instituto de Fomento Pesquero. 106 pp. (B). Avila M, C Merino, MI Piel, R Riquelme, K Guissen, P Pizarro, A Rojas. 2017. MANUAL PARA EL CULTIVO Y REPOBLAMIENTO DEL HUIRO NEGRO (Lessonia berteroana) Serie Programa Educativo Participativo para la Pesca Artesanal. III Cultivo y repoblamiento de Huiro negro. 47 pp

Figura 41. Cultivos de esporas en matraces de 2L de L. berteroana de 5 a 20mm de longuitud con aireación constante./ FUENTE: Avila M, C Merino, MI Piel, R Riquelme, K Guissen, P Pizarro, A Rojas. 2017. MANUAL PARA EL CULTIVO Y REPOBLAMIENTO DEL HUIRO NEGRO (Lessonia berteroana) Serie Programa Educativo Participativo para la Pesca Artesanal. III Cultivo y repoblamiento de Huiro negro. 47 pp

Figura 42. Cultivo de esporas en Cámara de cultivo con Botellones de 20L con aireación constante. / FUENTE: Avila M, C Merino, MI Piel, R Riquelme, K Guissen, P Pizarro, A Rojas. 2017. MANUAL PARA EL CULTIVO Y REPOBLAMIENTO DEL HUIRO NEGRO (Lessonia berteroana) Serie Programa Educativo Participativo para la Pesca Artesanal.III Cultivo y repoblamiento de Huiro negro. 47 pp
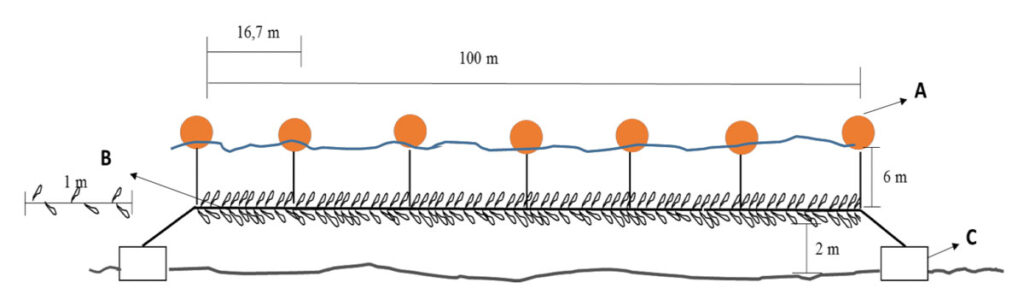
Figura 43. Esquema general del sistema suspendido de cultivo que se utiliza para algas pardas. Se observa el Long-line de cultivo para huiro. (A) Boyas (35 litros) (B) Cuerdas inoculadas con huiro (4-6 plántulas/metros) (C) Bloques de hormigón (500 kilos).

Figura 44. Esquema de encordado de una fronda sobre una línea para ser instalada en el mar.
Figura 45. Linea instalada en el mar con frondas de M. pyrifera. / FUENTE: Avila M, C Merino, MI Piel, R Riquelme, K Guissen, P Pizarro, A Rojas. 2017. MANUAL PARA EL CULTIVO Y REPOBLAMIENTO DEL HUIRO NEGRO (Lessonia berteroana) Serie Programa Educativo Participativo para la Pesca Artesanal. III Cultivo y repoblamiento de Huiro negro. 47 pp.
Etapa de Hatchery
Comienza con el crecimiento de los esporofitos en condiciones controladas y hasta el manejo para su traslado al mar.
Los esporofitos pueden ser utilizados en dos procesos:
1.- Pre-cultivo en cuerda, los esporfitos son fijados en cuerdas (bastidores) dentro de estanques con agua de mar hasta que alcanzan un tamaño adecuado (2 cm) para ser trasladados al mar.
2.-Pre-cultivo free floating, los esporofitos se mantienen flotando libremente en agua de mar dentro de matraces hasta alcanzar un tamaño adecuado (4 cm) para ser puestos en cuerdas (encordado) y posteriormente llevados al mar. Las condiciones óptimas son 15-16°C e iluminación de 37- 46 μmol m-2 s-1.
A medida que las plantas crecen la densidad de cultivo va disminuyendo, hasta llegar a una densidad aproximada de 25 plantas por litro.
Etapa de Mar
En esta etapa se instalan cabos o cuerdas con plántulas encordadas sobre una línea madre del long-line hasta la época de cosecha. En el sitio de cultivo, las plántulas inoculadas o encordadas son fijadas mediante amarracables a la línea madre (cuerda de 22 mm de diámetro) o elásticos usualmente de 100 m de longitud.
Factores importantes a considerar en el cultivo
M. pyrifera ha sido la experiencia de cultivo en el ambiente marino con mayor éxito en el norte de Chile, y Lessonia spp se encuentra aún en etapas experimentales. La implementación y rendimiento de los cultivos dependen de la estacionalidad, sitio del cultivo, la profundidad de cultivo, origen y calidad del material productivo, comportamiento latitudinal, entre otros factores.
También existe un efecto negativo de los epibiontes (por ejemplo, mitílidos, cirripedios) sobre los sistemas de cultivo flotante, así como especies de macroalgas de rápido crecimiento (por ejemplo, Ulva spp.) sobre las líneas de cultivo en primavera. Se recomienda implementar el cultivo durante los meses de otoño e invierno y cosechar antes de comenzar el verano para reducir el efecto negativo del epifitismo. Es primordial la limpieza y mantención de líneas de cultivo en el mar.
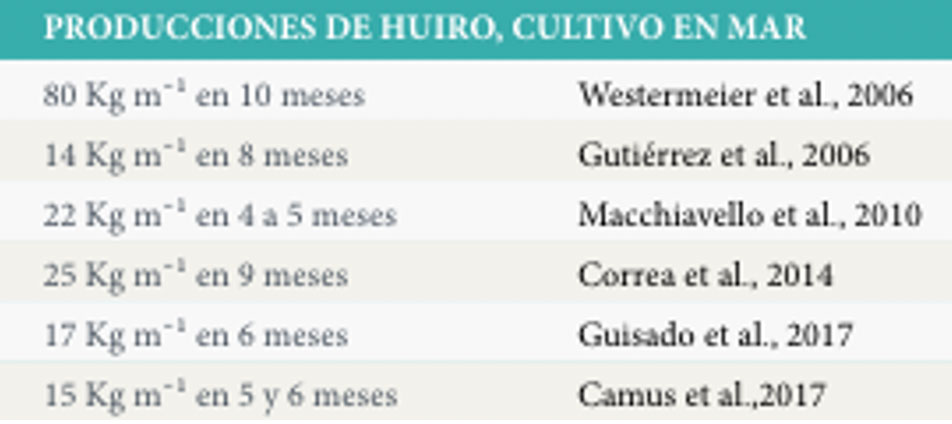
Tabla 8. Produccion de M. Pyrifera en etapa de mar. / FUENTE: (A) Saavedra S, Henríquez L, Leal P, Galleguillos F, Cook S, y Cárcamo F. (2019) – Cultivo de Macroalgas: Diversificación de la Acuicultura de Pequeña Escala en Chile. Convenio de Desempeño, Subsecretaría de Economía y Empresas de Menor Tamaño. Instituto de Fomento Pesquero. 106 pp.

Tabla 9. Produccion de L. spicata en etapa de mar. / FUENTE: (A) Saavedra S, Henríquez L, Leal P, Galleguillos F, Cook S, y Cárcamo F. (2019) – Cultivo de Macroalgas: Diversificación de la Acuicultura de Pequeña Escala en Chile. Convenio de Desempeño, Subsecretaría de Economía y Empresas de Menor Tamaño. Instituto de Fomento Pesquero. 106 pp.

Tabla 10. Produccion de L. trabeculata en etapa de mar. / FUENTE: (A) Saavedra S, Henríquez L, Leal P, Galleguillos F, Cook S, y Cárcamo F. (2019) – Cultivo de Macroalgas: Diversificación de la Acuicultura de Pequeña Escala en Chile. Convenio de Desempeño, Subsecretaría de Economía y Empresas de Menor Tamaño. Instituto de Fomento Pesquero. 106 pp.
Glosario
Anteridio: estructura reproductiva que produce gametos masculinos móviles (con uno o más flagelos).
Arqueospora: célula germinativa única formada por la maduración de una célula vegetativa.
Bastidores: marco de PVC donde se enrollan cuerdas (perlón, poli-propileno) que son utilizadas como sustrato para la jación de espo- ras.
Carpogonio: célula sexual femenina, en algas rojas, que contiene el huevo o gameto femenino.
Carpóspora: espora diploide de las algas rojas producida en un carposporangio, producto de la fertilización de la célula femenina y el espermacio.
Carposporangio: célula que contiene a las carpósporas.
Carposporofito: fase reproductiva diploide, en ciclo de vida de las algas rojas, que corresponde al desarrollo (sobre el gameto to femenino) del cigoto que luego de su desarrollo y madurez forma y libera carpósporas.
Ciclo de Vida: etapa completa de vida de un ser vivo.
Cigotospora: célula reproductiva producida por la fertilización del tricógino femenino por un espermacio.
Cistocárpica: fase reproductiva en algas rojas que se genera por reproducción sexual. Esta fase produce esporas diploides llamadas carpósporas.
Cistocarpo: cuerpo reproductivo que crece como una protuberancia en las algas rojas y que contiene a la fase carposporo to. Cuando el cistocarpo madura, libera carpósporas.
Conceptáculo: cavidad abierta a la super cie y que contiene estructuras reproductivas.
Conchospora: tipo de espora producida por los conchosporangios, durante una fase del ciclo de vida del Luche.
Conchosporangio: órgano generador de conchosporas en la fase conchocelis de luche.
Cosecha: acción de extraer la producción desde un centro de cultivo.
Diploide: células que poseen dos juegos de cromosomas homólogos (2n).
Epibionte: organismo que vive adherido a otro organismo/especie.
Epífito: algas u organismo vegetal que utiliza a otras algas o plantas como sustrato, no obtiene nutrientes desde sus hospederos.
Espora: célula reproductiva asexual en algas.
Esporofito: talos de algas que forman esporas para su reproducción.
Espermacio: célula reproductiva masculina, sin movilidad. Producidas en frondas gametofíticas de algas rojas.
Espermatangio: en algas rojas, célula reproductiva masculina que produce un espermacio.
Esporofila: fronda reproductiva ubicada en la base del talo de Macrocystis.
Esporulación: proceso de liberación de esporas.
Estipe: parte basal del talo de las algas, originado a partir del disco de fijación, y que sostiene a la fronda.
Fase conchocelis: estado asexual del ciclo de vida del luche.
Fecundación: proceso mediante el cual se fusionan gametos femeninos y masculinos para dar origen a un nuevo organismo.
Ficocoloides: coloide o gel que se obtiene de las paredes celulares de las macroalgas.
Fotoperiodo: lapso de tiempo de horas de luz, en un ciclo de 24 horas.
Fouling: conjunto de organismos indeseados y de rápido crecimiento que colonizan la estructura de cultivo de una especie reduciendo su disponibilidad de luz y movimiento en el agua para su desarrollo y crecimiento normal.
Fronda: Parte principal de una macroalga a cargo de la fotosíntesis y de la reproducción. Puede ser laminar, rami cada, tubular, filamentosa. Semejante a las hojas de una planta terrestre.
Gametofito: fase reproductiva haploide en el ciclo de vida de las algas rojas, se caracteriza por producir gametos: espermacios y oocélulas.
Gametos: células reproductivas sexuales.
Grampón: o disco de jación, estructura mediante la cual el talo se fija al sustrato.
Haploide: célula que en su núcleo presentan solo una serie simple de cromosomas (n).
Hatchery: espacio construido para la producción masiva de estados iniciales de alguna especie de macroalga que se quiere cultivar. En su interior se encuentra implementado con estanques, sistemas de circulación de agua de mar, filtros de agua, luz UV, sistemas de aireación, luz artificial, de temperatura etc.
Heteromórfico: ciclo de vida en que los talos del gameto to (n) y esporofito (2n) muestran diferentes morfologías, generalmente una macroscópica erecta y otra microscópica crustosa, lamentosa o postrada.
Meiosporangio: estructura en la cual se producen esporas por meiosis.
Mitilicultura: cultivo de los moluscos del género Mytilus (chorito, choro araucano, choro zapato) para su explotación económica.
Monospora: espora que se forma por división oblicua de una célula madre esporangial.
Oogonio: célula reproductiva femenina que contiene uno o más óvulos (gametos femeninos).
Oocélula: gameto femenino, sinónimo de óvulo.
Pectinicultura: cultivo del ostión (molusco bivalvo) para su explotación económica.
Talo: cuerpo vegetativo de las algas, que no diferencia estructuras definidas.
Tetráspora: en algas rojas, espora asexual producida en un tetraesporangio.
Tetrasporangio: en algas rojas, estructura reproductiva de la fase tetrasporfito que por meiosis produce esporas denominadas tetrásporas.
Tetrasporofito: fase reproductiva, en el ciclo de vida de las algas rojas, que se caracteriza por producir células reproductivas asexuales llamadas tetrásporas.
Tricógino: prolongación de la célula sexual femenina de algas rojas que recibe al espermacio en la fecundación.
Trifásico: o de tres fases, se utiliza para mencionar que un ciclo de vida (algas rojas) posee dos fases diploides (carposporo to y tetraspofito) y una haploide (gametofitos).
Valvas: caparazón calcáreo doble de moluscos filltradores (almejas, choritos).
Zoosporas: espora móvil provista de flagelos en algas pardas.
